Гидрид натрия
Гидрид натрия
| Гидрид натрия | |
|---|---|
 |
|
| Систематическое наименование |
Гидрид натрия, Натрий водородистый |
| Хим. формула | NaH |
| Рац. формула | NaH |
| Состояние | твёрдое |
| Молярная масса | 23,99777 г/моль |
| Плотность | 1.396 (20 °C) |
| Температура | |
| • плавления | 800 °C |
| • разложения | 300 °C |
| Энтальпия | |
| • образования | -56,4 кДж/моль |
| Рег. номер CAS | 7646-69-7 |
| PubChem | 24758 |
| Рег. номер EINECS | 231-587-3 |
| SMILES |
[H-].[Na+]
|
| InChI |
1S/Na.H/q+1;-1
BZKBCQXYZZXSCO-UHFFFAOYSA-N
|
| ChemSpider | 23144 |
| ЛД50 | 40 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
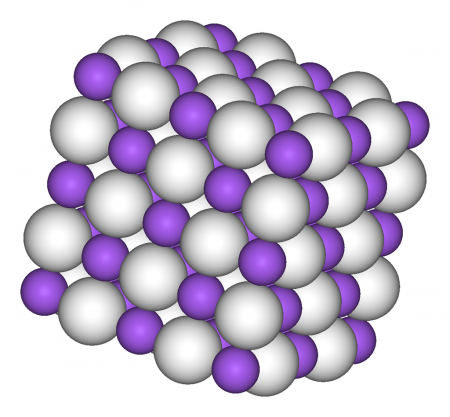
Гидрид натрия — сложное неорганическое вещество с химической формулой NaH.
Содержание
Описание
При стандартных условиях Гидрид натрия NaH представляет собой бесцветные кубические кристаллы с кристаллической решёткой типа NaCl. Является сильным восстановителем. Воспламеняется в атмосфере некоторых галогенов: фтора, хлора, а также при 230 °C в кислороде. При нагревании до 300 °C в вакууме Гидрид натрия NaH разлагается. Реагирует с водой, спиртами, жидким аммиаком, ацетиленом, трифторидом бора, оксидом углерода IV.
Получение
- Нагревание металлического натрия до 360—400 °C при пропускании водорода:
2 Na + H2 ⟶ 2NaH
- Взаимодействие натрия с гидроксидом натрия:
- Разложение амида натрия.
Химические свойства
1. Бурное взаимодействие с водой:
2. Разложение при сильном нагревании в вакууме:
2NaH ⟶ 2 Na + H2
Применение
Гидрид натрия NaH применяют для очистки железа от магнетита. В органической химии он используется в качестве конденсирующего и полимеризующего агента. Раствор NaH в гидроксиде натрия применяют для снятия окалины с тугоплавких металлов и специальных сталей.
