Дигидрофосфат натрия
Дигидрофосфат натрия
| Дигидрофосфат натрия | |
|---|---|
 |
|
| Систематическое наименование |
Дигидрофосфат натрия |
| Традиционные названия | Дигидроортофосфат натрия, фосфорнокислый натрий, однозамещённый |
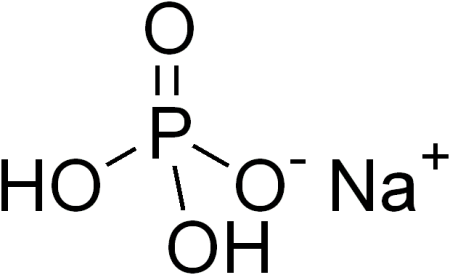
| Хим. формула | NaH2PO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 119,98 г/моль |
| Плотность | гидр. 1,9096 г/см³ |
| Т. плав. | гидр. 60 °C |
| Растворимость в воде | 85,220; 207,380 г/100 мл |
| ГОСТ | ГОСТ 245-76 |
| Рег. номер CAS | 7558-80-7 |
| PubChem | 24204 |
| Рег. номер EINECS | 231-449-2 |
| SMILES |
[Na+].[O-]P(=O)(O)O
|
| InChI |
1S/Na.H3O4P/c;1-5(2,3)4/h;(H3,1,2,3,4)/q+1;/p-1
AJPJDKMHJJGVTQ-UHFFFAOYSA-M
|
| Кодекс Алиментариус | E339(i) |
| ChEBI | 37585 |
| ChemSpider | 22626 |
| Токсичность | Нетоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дигидрофосфат натрия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой NaH2PO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты.
Содержание

Получение
- Нейтрализация концентрированной ортофосфорной кислоты разбавленным раствором едкого натра:
- Реакция гидрофосфата натрия с фосфорной кислотой:
-
- Na2HPO4 + H3PO4 → 2NaH2PO4
- Растворение белого фосфора в слабощелочном растворе перекиси водорода:
-
- P4 + 10H2O2 + 4NaOH → 4NaH2PO4 + 8H2O
Физические свойства
Дигидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле.
Образует несколько кристаллогидратов NaH2PO4·n H2O, где n = 1, 2, которые плавятся в кристаллизационной воде при 100, 60 °C соответственно.
Расплавы кристаллогидратов, равно как концентрированные растворы дигидрофосфата натрия представляют собой вязкие мутные опалесцирующие жидкости, легко кристаллизующиеся при понижении температуры в полупрозрачную стекловидную массу.
Химические свойства
- Кристаллогидрат теряет воду при нагревании в вакууме:
- При нагревании образует кислый дигидропирофосфат натрия:
-
- 2NaH2PO4 →160oC Na2H2P2O7 + H2O
- или Метафосфат натрия:
-
- NaH2PO4 →220−250oC NaPO3 + H2O
- Реагирует с щелочами:
- Вступает в обменные реакции:
-
- 3NaH2PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3 + 2H3PO4
Применение
Дигидрофосфат натрия является массовым продуктом химической промышленности. Типичная цена составляет порядка 800$/т.
- В фармакологии при изготовлении лекарственных препаратов используются слабительные, буферные и водоудерживающие свойства вещества.
- В пищевой промышленности Дигидрофосфат натрия используется в качестве многоцелевой пищевой добавки (код E339) и он выступает в качестве буфера и как стабилизатор окраски продуктов.
- Дигидрофосфат натрия входит в состав стиральных порошков и иных моющих средств, где выступает как умягчитель воды и буфер.
