Гидрид калия
Гидрид калия
| Гидрид калия | |
|---|---|
 K+ H− K+ H− |
|
| Систематическое наименование |
калия гидрид |
| Хим. формула | KH |
| Рац. формула | HK |
| Состояние | белое твердое вещество |
| Молярная масса | 40.1062 г/моль |
| Плотность | 1.47 г/см³ |
| Температура | |
| • плавления | 400 °C |
| Мол. теплоёмк. | 37,91 Дж/(моль·К) |
| Энтальпия | |
| • образования | -57,82 кДж/моль |
| Растворимость | |
| • в веществах | Бензол: не растворим Вода: реагирует диэтиловый эфир: не растворим сероуглерод: не растворим Этанол: реагирует |
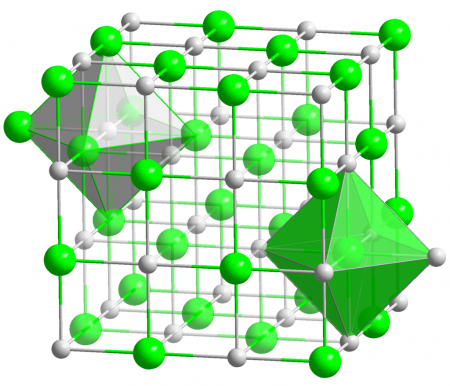
| Кристаллическая структура | кубическая, пространственная группа Fm3m |
| Рег. номер CAS | 7693-26-7 |
| PubChem | 82127 |
| Рег. номер EINECS | 231-704-8 |
| SMILES |
[H-].[K+]
|
| InChI |
1S/K.H/q+1;-1
OCFVSFVLVRNXFJ-UHFFFAOYSA-N
|
| ChEBI | 32589 |
| ChemSpider | 74121 |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH.
Содержание
Физические свойства
Гидрид калия образует бесцветные ионные кристаллы кубической сингонии с решеткой типа NaCl (a = 0.57 нм). Хорошо растворим в расплавленном калии, не растворяется в органических растворителях. Обладает высокой теплопроводностью.
Химические свойства
Гидрид калия является ионным соединением K+H−. Его расплав проводит электрический ток, при электролизе на аноде выделяется водород.
Вещество нестабильно и при нагревании распадается на компоненты:
- 2KH →400oC,vacuum 2K + H2
Гидрид калия обладает высокой химической активностью, является сильным восстановителем. Окисляется кислородом:
- 2KH + O2 →200oC 2KOH
Взаимодействует с водой:
кислотами:
спиртами:
- KH + HO−R → KOR + H2↑
и газообразным аммиаком:
- KH + NH3 →300oC KNH2 + H2↑
Взаимодействует с галогенами:
С углекислотой образует формиат калия:
- KH + CO2 →150oC,p K(HCOO)
Взаимодействует с оксидом кремния:
- 4KH + 3SiO2 →500oC 2K2SiO3 + Si + 2H2
Получение
Гидрид калия получают прямой реакцией расплавленного калия с водородом под давлением:
- 2K + H2 →200−350oC,p 2KH
Эта реакция была открыта Гемфри Дэви вскоре после его открытия в 1807 году калия, когда он отметил, что металл будет испаряться в токе водорода при нагревании только ниже точки кипения.
Токсичность
 Едкое вещество, разъедает органические вещества. Огнеопасно.
Едкое вещество, разъедает органические вещества. Огнеопасно.
