Сульфид меди (II)
Сульфид меди (II)
| Сульфид меди (II) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфид меди (II) |
| Традиционные названия | Сульфид меди, моносульфид меди |
| Хим. формула | CuS |
| Рац. формула | CuS |
| Состояние | твёрдое |
| Молярная масса | 95,61 г/моль |
| Плотность | 4,6 г/см³ |
| Показатель преломления | 1,45 |
| Рег. номер CAS | 1317-40-4 |
| PubChem | 14831 |
| Рег. номер EINECS | 215-271-2 |
| SMILES |
S=[Cu]
|
| InChI |
1S/Cu.S
BWFPGXWASODCHM-UHFFFAOYSA-N
|
| RTECS | GL8912000 |
| ChEBI | 51110 |
| ChemSpider | 14145 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид меди (II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди с серой. Чёрное, нерастворимое в воде и разбавленных растворах кислот вещество. Встречается в природе в виде редкого минерала ковеллина.
Получают прямым взаимодействием элементов или обменной реакцией солей двухвалентной меди с водорастворимыми сульфидами.
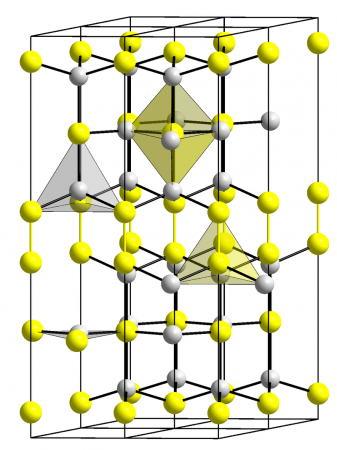
Полученный сухим путём (теплота образования из элементов 12 ккал/моль) Сульфид меди довольно хорошо проводит электрический ток (а ниже 1,66 K становится сверхпроводником). Рентгеноструктурное исследование его кристаллов выявило их совершенно особую и сложную структуру: Одна треть атомов меди находится в центрах треугольников из атомов серы [d (CuS) = 2,19 Å], а две трети - в центрах тетраэдров [d (CuS) = 2,32 Å]; кроме того, две трети атомов серы представлены группировками S2 ([S2]2−), подобными имеющимся в пирите. В связи с этим строение кристалла CuS можно было бы уточнённо выразить формулой CuI4 CuII2 [S−12]2S−22. Около 400 °C наступает заметное разложение сульфида по схеме 2CuS == Cu2S + S (давление диссоциации при 450 °C равно 80 мм рт. ст.). Известны также полисульфидные производные меди Cu2Sn (где n = 3 ÷ 6; а также CuS2) и её селенид CuSe (теплота образования из элементов 10 ккал/моль). Взаимодействием CuSO4 с насыщенным серой раствором полисульфида могут быть получены довольно устойчивые красные кристаллы тиосолей типа MCuS. (где M – NH4, K, Rb, Cs). Наименее растворима из них соль цезия.
Получение
Na2S+CuSO4=CuS+Na2SO4
