Новости
Нефтегазовая пром.
08.07.2025
Выставки
Наука и технология
20.06.2025
25.06.2025
Теги
Нитрат цинка
Нитрат цинка
| Нитрат цинка | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
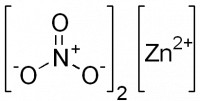
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 12825; 125073 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Zn+2]
|
| InChI |
1S/2NO3.Zn/c2*2-1(3)4;/q2*-1;+2
ONDPHDOFVYQSGI-UHFFFAOYSA-N
|
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
-
- ZnO + 2HNO3 → Zn(NO3)2 + H2O
-
- Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O
-
- ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
-
- Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Применение
- Протрава при крашении тканей.
|
Соединения цинка
|
|
|---|---|
|
|


