Хлорид титана IV
Хлорид титана IV
| Хлорид титана IV | |
|---|---|
 |
|
| Традиционные названия | тетрахлорид титана, четырёххлористый тита́н |
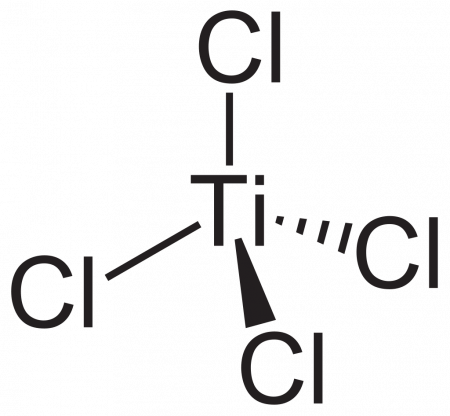
| Хим. формула | TiCl4 |
| Состояние | бесцветная дымящая жидкость |
| Молярная масса | 189,71 г/моль |
| Плотность | 1,726 г/см³ |
| Температура | |
| • плавления | −24,8 °C |
| • кипения | 136,4[1] °C |
| • вспышки | негорюч °C |
| Критическая точка | температура 365 °C, давление 5,01 МПа |
| Энтальпия | |
| • образования | −804,16 кДж/моль |
| Растворимость | |
| • в воде | реагирует с водой, образуя TiO2 и HCl |
| • в | растворим в этаноле, диэтиловом эфире |
| Кристаллическая структура | моноклинная |
| Дипольный момент | 0 Д |
| Рег. номер CAS | 7550-45-0 |
| PubChem | 24193 |
| Рег. номер EINECS | 231-441-9 |
| SMILES |
Cl[Ti](Cl)(Cl)Cl
|
| InChI |
1S/4ClH.Ti/h4*1H;/q;;;;+4/p-4
XJDNKRIXUMDJCW-UHFFFAOYSA-J
|
| RTECS | XR1925000 |
| Номер ООН | 1838 |
| ChemSpider | 22615 и 141410 |
| Пиктограммы СГС |     |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид титана IV (тетрахлорид титана, четырёххлористый титан) — бинарное соединение титана и хлора с формулой TiCl4. При нормальных условиях - бесцветная подвижная прозрачная ядовитая жидкость, дымящая на воздухе.
Содержание
Физические свойства
- Температура кипения: 136,4 °C
- Температура плавления: −24,1 °C
- Относительная плотность (Вода = 1): 1,7
- Растворимость в воде — реагирует
- Давление паров, кПа при 21,3 °C: 1,3
- Относительная плотность пара (воздух = 1): 6,5
- Критическая температура 365 °C, критическое давление 5,01 МПа
Химические свойства
Гидролизуется водой и водяным паром с выделением хлористого водорода и образованием оксидов и оксихлоридов титана. На этой реакции основано применение хлорида титана(IV) на флоте в качестве образователя дымовой завесы. Способен присоединять NH3, ароматические соединения, простые эфиры.
Выше 500—600 °C окисляется O2 воздуха до TiO2, в присутствии паров воды образуются также оксихлориды TiOCl2, Ti2O3Cl2.
Бурно реагирует с водой с получением TiO2·nH2O, в качестве промежуточных продуктов образуются гидрат TiCl4·5H2O и гидроксохлориды Ti(OH)nCl4−n·xH2O. Растворим в этаноле и диэтиловом эфире.
При очень медленном добавлении воды с тщательным перемешиванием и охлаждением можно получить устойчивые концентрированные растворы TiCl4.
С парами воды при 300—400 °C даёт TiO2.
Восстанавливается водородом H2 и активными металлами до TiCl2 и TiCl3, затем до Ti.
В TiCl4 растворим хлор Сl2 (7,6 % по массе при 20 °C), незначительно растворим хлороводород НСl.
Смешивается во всех соотношениях с жидким НСl, а также с хлоридами Sn, С, Si.
Растворим в соляной кислоте при пропускании газообразного НСl с получением ярко-жёлтого раствора гексахлортитановой кислоты (H2TiCl6).
С разбавленной серной кислотой H2SO4 образует TiOSO4, с концентрированной H2SO4 образует TiCl2SO4.
Получение
Тетрахлорид титана можно получить взаимодействием диоксида титана с хлором в присутствии восстановителя (углерода):
-
- TiO2 + 2 Cl2 + C → TiCl4 + CO2
Для получения TiCl4 высокой чистоты используют ректификацию и адсорбцию примесей на силикагеле.
В промышленности хлорид титана(IV) производится в процессе хлорирования, который предусматривает обработку титановой руды хлором. Реакция ильменита (FeTiO3) с хлором и углеродом (в виде кокса) происходит при температуре 900 °C:
- 2 FeTiO3 + 7 Cl2 + 6 C ⟶ 2 TiCl4 + 2 FeCl3 + 6 CO
После хлорирования полученный тетрахлорид титана очищают фильтрованием, гидролизом с помощью увлажнённого NaCl (удаление As), восстановлением медью, алюминием или сероводородом H2S (удаление ванадия, серы, хрома, органики), дистилляцией и ректификацией.
Применение
Используют TiCl4 для получения титана, оксида титана, катализаторов (для полимеризации этилена и пропилена, для алкилирования ароматических углеводородов и др.) и как дымообразователь.
Также применяется:
- в производстве губчатого титана;
- в производстве пигмента — титановых белил;
- в качестве катализатора в химической промышленности (см. Катализаторы Циглера — Натта).
Токсичность
Тетрахлорид титана токсичен при вдыхании паров и воздействии на кожу, поражает слизистые оболочки рта и верхних дыхательных путей, а также роговицы глаз. Вызывает ожоги кожи и бронхит. ПДК паров 1 мг/м3.
